2025.06.20
研究ニュース
海洋の窒素循環を解明する新たな研究
~アナモックスの酸素同位体分別測定に初めて成功~
ポイント
・アナモックス細菌は非生物学的な酸素同位体交換速度の約8〜12倍の速度で酸素同位体交換を行う。
・急速な酸素同位体交換がδ¹⁸ONO₃⁻を書き換え、アナモックス由来の酸素同位体シグナルが消失する。
・NO2-→NO3-の反応では、重い¹⁸Oが先に反応する逆同位体分別(¹⁸εNO₂⁻→NO₃⁻<0)を示した。
概要
北海道大学大学院工学研究院の岡部 聡教授、海洋研究開発機構(JAMSTEC)の小林香苗特任研究員らの研究グループは、嫌気性アンモニア酸化(アナモックス*1)反応における酸素同位体分別(18ε)を求めることに世界で初めて成功しました。
海洋の窒素循環は、地球環境の維持に不可なサイクルであり、その仕組みを正確に理解することにより、気候変動対策や生態系の保全に大きく寄与することができます。しかし、その中で重要な役割を果たす嫌気性アンモニア酸化(アナモックス)による窒素除去のプロセスについては、まだ未解明な点が多く残されています。特に、アナモックスの酸素同位体分別(¹⁸ε)は、反応が複雑であるためこれまで全く研究が行われていませんでした(図1)。本研究では、海洋性アナモックス細菌Ca. Scalindua sp. (以下Scalindua)の高度に集積した培養液を用いて、アナモックス反応の酸素同位体分別(¹⁸ε);(1) NO₂⁻からN₂への変換(¹⁸εNO₂⁻→N₂)、(2) NO₂⁻からNO₃⁻への酸化(¹⁸εNO₂⁻→NO₃⁻)、(3) NO₂⁻酸化時の水由来の酸素(O)の取り込み(¹⁸εH₂O)、の測定に世界で初めて成功しました(図2)。さらに、Scalindua は、亜硝酸(NO₂⁻)と水(H₂O)の間での酸素同位体交換を、従来の非生物的な交換速度の約8〜12倍の速さで促進することが確認されました。その結果、NO2-中のO原子の約34%が、硝酸(NO₃-)へ酸化される前にH2Oと交換され、さらに、NO3-への酸化過程で1個のO原子がH2OからNO2-に取り込まれることが確認されました。この反応により、亜硝酸酸化によって生成されるNO₃⁻の酸素同位体比(δ¹⁸O NO₃⁻)*2が、周囲の水の酸素同位体比(δ¹⁸OH₂O)に急速に近づく現象が明らかになりました(図3)。
既往の研究では、好気的な硝化反応(酸素存在下でアンモニアが硝酸に酸化される反応)によって生成される硝酸(NO₃⁻)の酸素同位体比(δ¹⁸O NO₃⁻)は、亜硝酸(NO₂⁻)と水(H₂O)の間の酸素同位体交換や、分子状酸素(O2)や水からの酸素の取り込みによる同位体効果により、周囲の水の酸素同位体比に近づくことが知られていました。今回の研究成果では、これに加えて、無酸素(嫌気)環境下において、アナモックス細菌により亜硝酸が硝酸へ酸化される際も、同様の現象が起こることが確認されました。この結果は、海洋の窒素の損失量を評価するための地球化学的指標である δ¹⁸ONO₃⁻ や δ¹⁸ONO₂⁻ が水の酸素同位体比によって書き換えられ、アナモックスや脱窒の酸素同位体シグナルが消失する可能性があることを示しています。そのため、海洋の窒素循環を評価する際には、これらの指標の変動を慎重に分析する必要があります。
なお、本研究成果は、2025年6月2日(月)公開のThe ISME Journal誌にオンライン掲載されました。
【背景】
海洋の窒素循環を理解することは、生態系の健全性や地球規模の環境変化を把握するために不可欠です。
窒素循環の定量的評価には長年、窒素安定同位体比(δ¹⁵N)が活用されてきましたが、近年では硝酸(NO₃⁻)と亜硝酸(NO₂⁻)の酸素安定同位体比(δ¹⁸O)の測定が可能となり、窒素と酸素の両方の動きを追跡することで、より精密な窒素循環プロセスの推定が可能になってきました。
個々の生物学的反応の寄与率を推定するには、窒素、酸素同位体分別(¹⁵ε、¹⁸ε)*3の情報が不可欠です。
硝化や脱窒に関する研究は進んでいますが、海洋の酸素極小層*4で重要な役割を果たす嫌気性アンモニウム酸化(アナモックス)細菌については未解明の部分が多いです。特に、アナモックス細菌は増殖速度が遅く培養が困難であり、報告されているのは淡水性アナモックス細菌の窒素同位体分別(¹⁵ε)のみです(図1)。海洋性アナモックス細菌の窒素、酸素同位体分別、特に酸素同位体分別(¹8ε)の詳細は未解明のままとなっています。
本研究では、未解明の海洋性アナモックス細菌による窒素、酸素同位体分別を測定し、海洋の窒素循環におけるアナモックス反応の寄与を明らかにすることを目的としました。
【研究手法】
異なる酸素安定同位体比に調整した重水(H218Oの比率が高い水)を用い、海洋性アナモックス細菌Ca. Scalindua sp.の回分培養実験を行い、NH4+、NO2-、NO3-の濃度及び窒素、酸素同位体比の経時変化を測定しました。これらの実験データから窒素、酸素同位体分別(¹⁵ε、¹⁸ε)を導出するために、新たな数値モデルを構築しマルコフ連鎖モンテカルロ法(MCMC)アルゴリズムを利用したパラメータ推定を行いました。ベイズ的アプローチにより、実験データにモデルをカーブフィッティングさせることで、アナモックス反応における以下の三つの酸素同位体分別(¹⁸ε)を推定しました: (1)亜硝酸還元反応18ε NO₂⁻→ N₂ 、(2)亜硝酸酸化反応18ε NO₂⁻→ NO₃⁻ 、及び(3)亜硝酸酸化過程の水の酸素分子の取り込み(18ε H₂O)。さらに、アナモックス細菌による亜硝酸(NO2-)と水(H2O)の間の酸素同位体交換速度定数(k eq, AMX)を定量しました。
【研究成果】
海洋性アナモックス細菌Ca. Scalindua sp.は、非生物学的な酸素同位体交換速度(k eq, abio = 1.13 ×10-² h-¹)の約8〜12倍の速度(k eq, AMX = 8.44 ~ 13.56 ×10-² h-¹)でNO₂⁻とH₂Oの間で酸素同位体交換を行うことが明らかとなりました。このアナモックス反応を介した酸素同位体交換の新しい速度を数値計算モデルに導入し、以下の18εを推定しました: (1)NO2-からN2への変換(18εNO₂⁻→N₂ = 10.6 ~ 16.1‰、千分率で1,000分の1)、(2)NO2-からNO3-への酸化(18εNO₂⁻→NO₃⁻= -2.9 ~ -11.0‰、逆同位体分別*5)、(3)NO2-からNO3-への酸化の際の水からの酸素原子の取り込み(18εH₂O = 16.4 ~ 19.2‰)(図2)。
これまでの研究で、好気性の硝化反応で生成されるNO3-(NO3-中の3個の酸素原子のうち2個はH2Oに由来)のδ18Oは、NO2-とH₂Oの同位体平衡、及び分子状酸素(O2)とH₂Oからの酸素原子の取り込み時の同位体分別によって、周囲の水のδ18Oに収束することが知られていました。本研究ではさらに、アナモックス細菌によるNO2-からNO3-への嫌気的酸化(NO3-中の1個の酸素原子がH2Oに由来)においても、NO2-とH2O間の急速な酸素同位体交換によって、生成されるNO3-のδ18Oの値は、周囲の水のδ18Oの値に限りなく近づくことが明らかとなりました(図3)。したがって、δ18O NO₃⁻とδ18O NO₂⁻を地球化学的指標として使用し、海洋における固定窒素損失へのアナモックスや脱窒反応の潜在的寄与を評価する際には、無酸素条件下でもこれらの反応由来の酸素同位体シグナルが消失する可能性があるため、慎重な分析が求められます。アナモックスを介したNO2-とH2Oの間の酸素同位体交換が自然環境においてどの程度進行しているのか、またδ¹⁸ONO₃⁻ 及びδ¹⁸ONO₂⁻ にどの程度影響を及ぼしているのかを明確にするためには、さらなる研究が不可欠です。
【今後への期待】
本研究の成果は、海洋の窒素循環におけるアナモックス反応の役割をより正確に理解するための、欠けていた重要なピースを補う画期的な一歩となりました。今後、この知見を活かし、海洋窒素循環モデルの精密化を進めることで、気候変動予測や生態系保全への貢献が期待されます。窒素循環の正確な理解を深めることで、持続可能な海洋資源の管理や気候変動対策に寄与していきたいと考えています。
【謝辞】
Dr. S. D.ワンケルとDr. K. L. カシオティからNO₂-標準物質の校正と実験方法に関して有意義な意見をいただきました。ここに記して感謝いたします。本研究は、日本学術振興会科学研究費補助金JP18J20742(小林香苗に交付)、科学研究費補助金JP18H04138(小林香苗)、科学研究費補助金JP20K20316(小林香苗)、科学研究費補助金JP19H00776(岡部 聡)、科学研究費補助金JP23H00192(岡部 聡)、京都大学生態学研究センター共同利用・共同研究助成(助成番号:2016jurc- cer24)(木庭啓介)の助成を受けて実施しました。
論文情報
論文名:Oxygen isotope fractionation during anaerobic ammonium oxidation by the marine representative Candidatus Scalindua sp.(海洋性アナモックス細菌 Candidatus Scalindua sp. による嫌気的アンモニア酸化に伴う酸素同位体分別)
著者名:小林香苗1(研究当時)、2、仁科一哉3、福島慶太郎4(研究当時)、6、大西雄二4(研究当時)、7、眞壁明子2、押木守5、木庭啓介4、岡部 聡5(1北海道大学大学院工学院、2海洋研究開発機構、3国立環境研究所、4京都大学、5北海道大学大学院工学研究院、6福島大学農学群食農学類、7総合地球環境学研究所)
雑誌名:The ISME Journal(Oxford Academic)(微生物生態学の専門誌)
DOI:10.1093/ismejo/wraf115
公表日:2025年6月2日(月)(オンライン公開)
お問い合わせ先
お問い合わせ先
北海道大学大学院工学研究院 教授 岡部 聡(おかべさとし)
TEL 011-706-6266
メール sokabe[at]eng.hokudai.ac.jp [at]を@へ変更してください。
URL https://www.eng.hokudai.ac.jp/labo/water/index.html
配信元
北海道大学社会共創部広報課(〒060-0808 札幌市北区北8条西5丁目)
TEL 011-706-2610 FAX 011-706-2092
メール jp-press[at]general.hokudai.ac.jp [at]を@へ変更してください。
海洋研究開発機構海洋科学技術戦略部報道室(〒236-0001 横浜市金沢区昭和町3173-25)
TEL 045-778-5690
メール press[at]jamstec.go.jp [at]を@へ変更してください。
総合地球環境学研究所広報室(〒603-8047 京都市北区上賀茂本山457番地4)
TEL 075-707-2450・2128 FAX 075-707-2106
メール kikaku@chikyu.ac.jp [at]を@へ変更してください。
国立環境研究所企画部広報室(〒305-8506 つくば市小野川16-2)
メール kouhou0[at]nies.go.jp [at]を@へ変更してください。
京都大学広報室(〒606-8501 京都市左京区吉田本町36番地1)
TEL 075-753-5729 FAX 075-753-2094
メール comms[at]mail2.adm.kyoto-u.ac.jp [at]を@へ変更してください。
福島大学総務課広報・渉外室(〒960-1296福島市金谷川1番地)
TEL 024-548-5190 FAX 024-548-3180
メール kouho[at]adb.fukushima-u.ac.jp [at]を@へ変更してください。
【参考図】
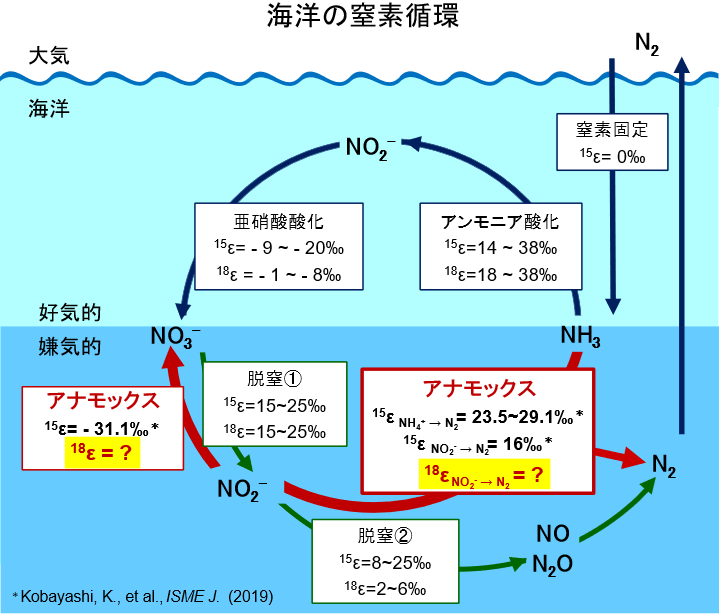 図1.海洋の窒素循環における窒素(¹⁵ε)、酸素(¹⁸ε)同位体分別。「?」は最後の欠けているピース(アナモックス反応の¹⁸ε)を示す
図1.海洋の窒素循環における窒素(¹⁵ε)、酸素(¹⁸ε)同位体分別。「?」は最後の欠けているピース(アナモックス反応の¹⁸ε)を示す
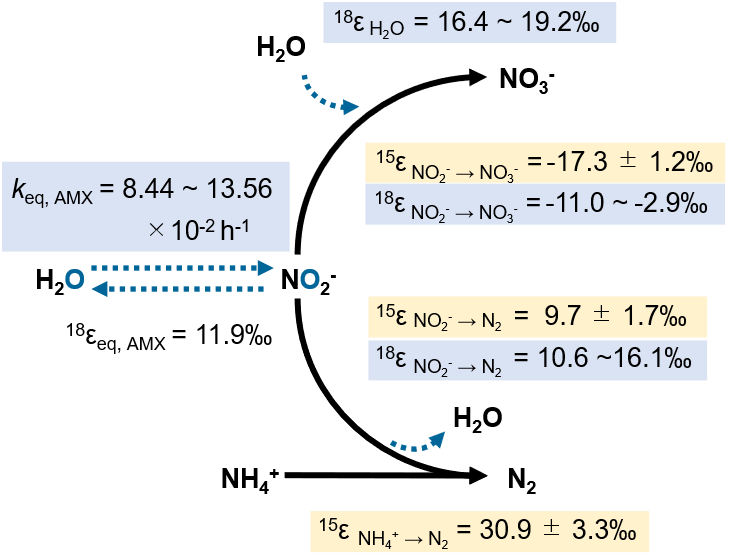 図2.本研究で測定されたアナモックス反応の窒素(¹⁵ε)、酸素(¹⁸ε)同位体分別とNO₂とH₂Oの間の酸素同位体交換速度(k eq, AMX)
図2.本研究で測定されたアナモックス反応の窒素(¹⁵ε)、酸素(¹⁸ε)同位体分別とNO₂とH₂Oの間の酸素同位体交換速度(k eq, AMX)
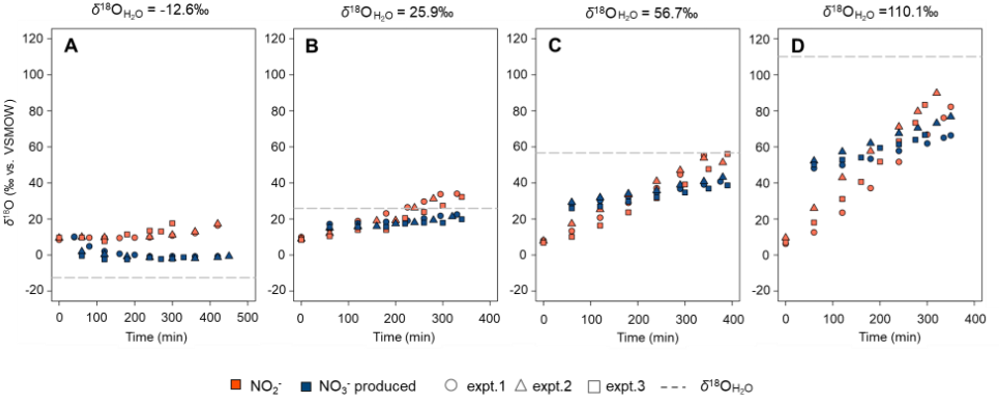 図3.アナモックス反応で生成されたNO3-の酸素同位体比(δ¹⁸NO₃⁻、青色のマーカー)が水の酸素同位体比(δ¹⁸H₂O、点線)に近づいている
図3.アナモックス反応で生成されたNO3-の酸素同位体比(δ¹⁸NO₃⁻、青色のマーカー)が水の酸素同位体比(δ¹⁸H₂O、点線)に近づいている
【用語解説】
*1 アナモックス(嫌気性アンモニウム酸化) … 酸素を必要とせずにアンモニウム(NH₄⁺)を亜硝酸(NO₂⁻)と反応させて窒素ガス(N₂)を生成する微生物による代謝プロセス。アナモックスは、海洋の酸素が乏しい環境で、窒素除去の主要なプロセスの一つとして機能している。
*2 酸素安定同位体比(δ¹⁸O) … 酸素には、質量数 16(¹⁶O)、17(¹⁷O)、18(¹⁸O)の同位体があり、測定試料(sample)の酸素同位体の存在比(18R = [¹⁸O]/[¹⁶O])を標準物質(std)の同位体比の存在比のずれとして千分率で表す δ¹⁸O = (18Rsample/18Rstd – 1)×1000(‰)。特に硝酸(NO₃⁻)や亜硝酸(NO₂⁻)の酸素同位体比(δ¹⁸O)は、窒素化合物の起源や代謝プロセスを解析するために用いられる。
*3 酸素同位体分別(¹⁸ε) … 生物や化学的反応や物理過程において、異なる酸素同位体(¹⁶O、¹⁷O、¹⁸O)の比率が変化する現象で、平衡同位体分別と動力学的同位体分別がある。
平衡同位体分別は、反応物と生成物の間の化学的平衡によって同位体の分布が決まる。
動力学的同位体分別は、軽い同位体と重い同位体の取り込み速度の違いによって決まる。
ε (‰) = [(kL / kH) – 1] ×1000、ここで、kLとkHはそれぞれ軽い同位と重い同位体の一次反応速度定数である。
*4 酸素極小層 … 栄養塩が豊富な海洋では微生物の呼吸活動が活発になり、酸素が消費されるため、海洋の中層で酸素濃度が極端に低くなる領域。
*5 逆同位体分別 … 一般的な生物学的プロセスでは、軽い同位体が反応しやすく、その結果、生成物には軽い同位体が濃縮される通常の同位体分別となる。しかし、逆同位体分別では重い同位体が優先的に反応し、生成物には重い同位体が濃縮され、反応物には軽い同位体が残る。